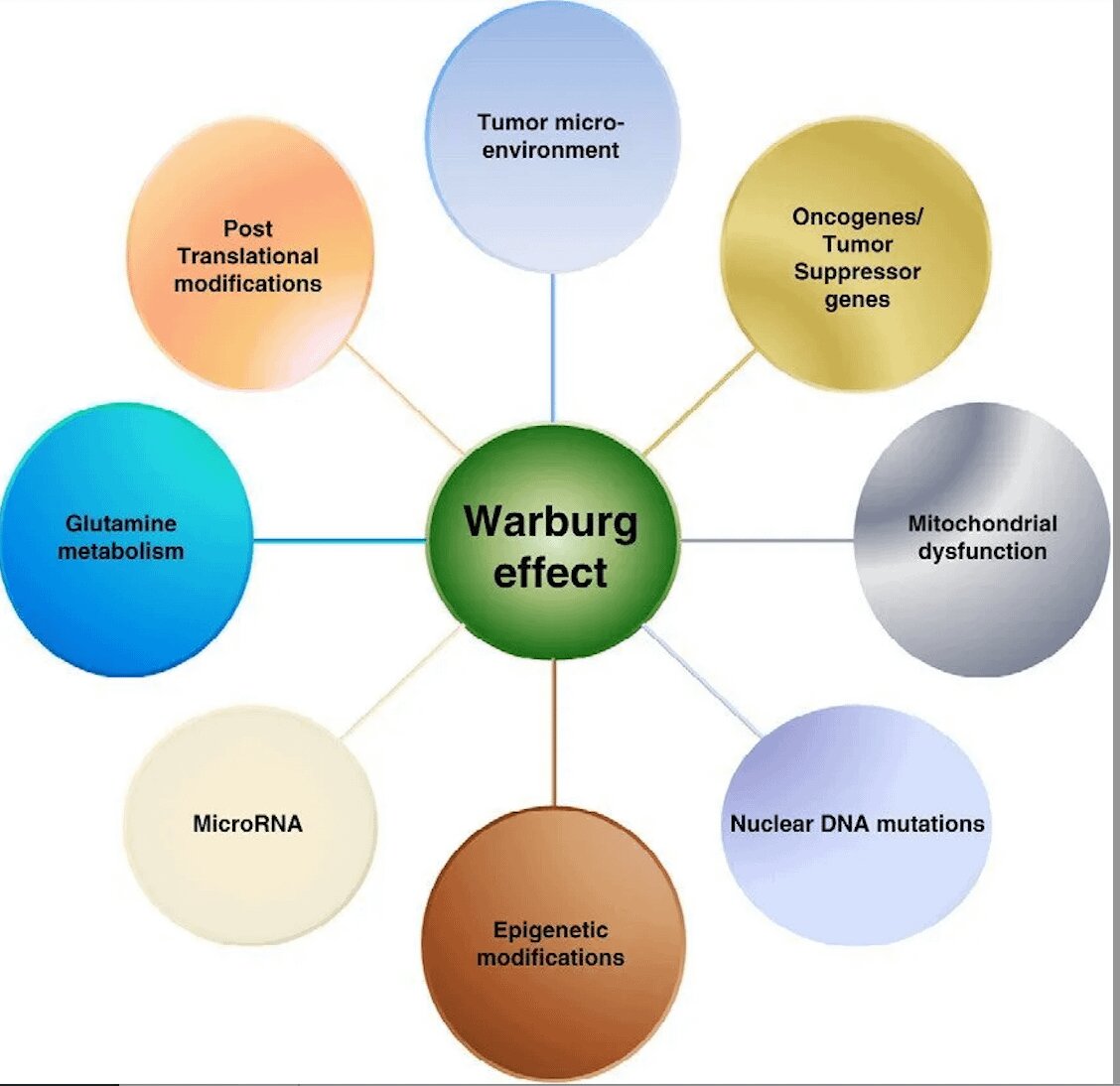
Abstract: Questo articolo esplora il ruolo cruciale del metabolismo glicolitico nel sostenere la pluripotenza delle cellule staminali. Analizziamo come il metabolismo glicolitico fornisce l'energia e i precursori biochimici necessari per il mantenimento e la proliferazione di cellule altamente indifferenziate. Esaminiamo anche le implicazioni di questo metabolismo per le strategie di terapia cellulare e la medicina rigenerativa. Introduzione: La pluripotenza, la capacità di una cellula staminale di differenziarsi in vari tipi cellulari, è un concetto fondamentale nella biologia dello sviluppo e nella medicina rigenerativa. Una caratteristica distintiva delle cellule staminali pluripotenti è il loro unico profilo metabolico, dominato dalla glicolisi. Questo articolo si propone di esaminare in dettaglio il ruolo del metabolismo glicolitico nel sostenere la pluripotenza delle cellule staminali. Efficienza Energetica e Mantenimento della Pluripotenza: Metabolismo Glicolitico nelle Cellule Staminali: Le cellule staminali mantengono un elevato tasso di glicolisi, un processo che converte il glucosio in piruvato producendo ATP, anche in condizioni di adeguata disponibilità di ossigeno. Questo processo è noto come "effetto Warburg" e differisce notevolmente dal metabolismo ossidativo più comune nelle cellule differenziate. Vantaggi Energetici della Glicolisi: Nonostante la glicolisi produca meno ATP per molecola di glucosio rispetto alla respirazione mitocondriale, presenta vantaggi in termini di velocità di produzione di energia e fornitura rapida di intermedi metabolici per la biosintesi necessaria alla proliferazione cellulare. Induzione dell'effetto Warburg nelle cellule somatiche L'induzione dell'effetto Warburg in cellule somatiche, cioè la promozione di un metabolismo prevalentemente glicolitico anche in presenza di ossigeno, può essere influenzata da vari approcci, inclusi quelli dietetici e farmacologici. L'effetto Warburg è noto per essere una caratteristica di molti tipi di cellule tumorali, ma è anche rilevante nel contesto delle cellule staminali e della riprogrammazione cellulare. Ecco alcune strategie che potrebbero essere utilizzate per indurre un simile cambiamento metabolico in cellule somatiche: Restrizione Calorica: La restrizione calorica può influenzare il metabolismo cellulare. Riducendo l'apporto calorico, le cellule possono essere indotte a passare da un metabolismo basato sulla fosforilazione ossidativa a uno più dipendente dalla glicolisi. Dieta Chetogenica: Questa dieta, alta in grassi e bassa in carboidrati, può alterare il metabolismo energetico delle cellule, promuovendo la lipolisi e la produzione di corpi chetonici, che possono influenzare il metabolismo cellulare e potenzialmente indurre variazioni nello stato redox delle cellule. Inibitori della Glicolisi: Paradossalmente, l'uso di inibitori della glicolisi come la 2-deossi-D-glucosio (2-DG) può indurre un adattamento cellulare che potenzia la glicolisi una volta che l'inibizione viene rimossa. Modulatori del Metabolismo Ossidativo: Farmaci che alterano il funzionamento mitocondriale, come alcuni agenti chemioterapici, possono spingere le cellule a dipendere maggiormente dalla glicolisi. Agenti che Inducono Ipossia: L'utilizzo di agenti che mimano le condizioni di ipossia può stimolare l'espressione del fattore inducibile dall'ipossia (HIF), che a sua volta può promuovere un metabolismo più glicolitico. Metformina: Questo farmaco comunemente usato nel trattamento del diabete di tipo 2 è noto per influenzare il metabolismo cellulare e potrebbe avere un effetto sulla promozione di un profilo metabolico più glicolitico. Inibizione della Catena Respiratoria Mitocondriale: La metformina agisce principalmente inibendo il complesso I della catena respiratoria mitocondriale. Questo riduce la fosforilazione ossidativa e può aumentare la dipendenza della cellula dalla glicolisi per la produzione di energia. Attivazione del Fattore Inducibile dall'Ipossia (HIF): Attraverso la riduzione dell'efficienza mitocondriale, la metformina può attivare HIF, un fattore di trascrizione che promuove l'espressione di geni coinvolti nella glicolisi e nella sopravvivenza in condizioni di basso ossigeno. Effetto sulla Sensibilità all'Insulina: La metformina aumenta la sensibilità all'insulina e altera il metabolismo del glucosio, promuovendo un utilizzo aumentato del glucosio attraverso la glicolisi. Cellule con Alta Attività Metabolica: Le cellule che hanno già un metabolismo elevato, come alcune cellule tumorali, possono essere particolarmente sensibili agli effetti della metformina. Cellule con Disfunzione Mitocondriale: Le cellule che dipendono maggiormente dalla fosforilazione ossidativa per la produzione di energia possono essere più sensibili agli effetti inibitori della metformina sul metabolismo mitocondriale. Metformina: Come già discusso, può indurre un metabolismo più glicolitico e influenzare la riprogrammazione cellulare. VLCD e AAE (Dieta a Bassissimo Contenuto Calorico Arricchita di Amminoacidi): Può ridurre l'apporto calorico complessivo, potenzialmente promuovendo un metabolismo cellulare più efficiente e riducendo lo stress ossidativo. Vitamina C: Agisce come antiossidante e può sostenere la riprogrammazione cellulare riducendo lo stress ossidativo. Cellule Tumorali con Alta Attività Metabolica: Molti tipi di cellule tumorali hanno un metabolismo elevato e mostrano l'effetto Warburg, ovvero una preferenza per la glicolisi anziché per la fosforilazione ossidativa, anche in presenza di ossigeno. La metformina può influenzare negativamente il metabolismo di queste cellule, riducendo la loro proliferazione e sopravvivenza. Cellule con Disfunzione Mitocondriale: Le cellule con disfunzioni mitocondriali o con dipendenza elevata dalla respirazione mitocondriale per il loro apporto energetico possono essere particolarmente vulnerabili all'azione della metformina. Questo include alcuni tipi di cellule tumorali e cellule con patologie metaboliche. Cellule Muscolari: Le cellule muscolari, che dipendono in modo significativo dalla fosforilazione ossidativa, possono essere sensibili alla metformina, specialmente in condizioni di resistenza all'insulina o di diabete. Cellule Epatiche: La metformina ha mostrato di influenzare il metabolismo del glucosio nel fegato, riducendo la gluconeogenesi e migliorando la sensibilità all'insulina in queste cellule. Cellule Adipose: La metformina può influenzare anche il metabolismo delle cellule adipose, in particolare nelle condizioni di obesità e diabete di tipo 2, dove può migliorare la sensibilità all'insulina. Cellule del Pancreas: In particolare le cellule beta del pancreas, che sono responsabili della produzione di insulina, possono essere influenzate dalla metformina, specialmente in condizioni di stress metabolico. Modulazione del Metabolismo: La metformina, come inibitore del complesso I della catena di trasporto degli elettroni mitocondriali, può spostare il metabolismo cellulare dalla fosforilazione ossidativa alla glicolisi. Questo cambiamento può influenzare il mantenimento e il destino delle cellule staminali, dato che il loro stato metabolico è strettamente correlato alla loro funzione e stato di differenziazione. Regolazione dell'Omeostasi Redox: Attraverso l'alterazione del metabolismo mitocondriale, la metformina può influenzare l'equilibrio redox nelle cellule staminali. Un ambiente redox più ridotto è favorevole per mantenere la pluripotenza delle cellule staminali. Influenza sulla Senescenza Cellulare: La metformina ha dimostrato di influenzare la senescenza cellulare. Potrebbe estendere la longevità delle cellule staminali, aumentando la loro disponibilità per il rinnovamento tessutale e la riparazione. Effetti sull'Autofagia e sulla Sopravvivenza Cellulare: La metformina può promuovere l'autofagia, un processo essenziale per la pulizia cellulare e la rimozione dei componenti danneggiati, che è cruciale per il mantenimento e la funzionalità delle cellule staminali. Potenziamento della Riprogrammazione: La vitamina C è nota per migliorare l'efficienza della riprogrammazione delle cellule somatiche in cellule staminali pluripotenti indotte (iPSCs). Agisce come cofattore per le prolin idrossilasi, influenzando la demetilazione del DNA e la modificazione degli istoni, processi importanti nella riprogrammazione epigenetica. Protezione dallo Stress Ossidativo: Come potente antiossidante, la vitamina C protegge le cellule staminali dal danno ossidativo, contribuendo alla loro integrità e funzionalità. Promozione della Differenziazione: Studi hanno mostrato che la vitamina C può influenzare la differenziazione delle cellule staminali, ad esempio favorire la formazione di osteoblasti dalle cellule staminali mesenchimali. Mantenimento dell'Omeostasi Redox: Analogamente alla metformina, la vitamina C contribuisce al mantenimento di un ambiente redox favorevole per le cellule staminali. Effetti Combinati: L'uso combinato di metformina e vitamina C potrebbe avere effetti sinergici sulle cellule staminali, potenziando sia il loro mantenimento in uno stato non differenziato sia la loro funzionalità. Ricerca Futura: Sebbene i dati attuali siano promettenti, sono necessari ulteriori studi per comprendere pienamente l'interazione tra la metformina, la vitamina C e le cellule staminali, soprattutto per quanto riguarda le applicazioni terapeutiche nella medicina rigenerativa. Effetto Senolitico indotto dalla della Metformona e dalla Vitamina C La Metformina e la Vitamina C hanno mostrato potenzialità nel campo dei senolitici, ovvero sostanze capaci di indurre la morte delle cellule senescenti, un processo che potrebbe attivare e influenzare le cellule staminali. Tuttavia, è importante chiarire che l'effetto Warburg, sebbene correlato a cambiamenti metabolici, non è direttamente classificato come senolitico. Induzione dell'Apoptosi nelle Cellule Senescenti: La metformina può indurre l'apoptosi in cellule senescenti. La sua azione sembra essere mediata dalla modulazione del metabolismo cellulare e dalla riduzione dell'infiammazione cronica associata alla senescenza. Modulazione del Metabolismo: Alterando il metabolismo mitocondriale e favorendo un ambiente redox ridotto, la metformina può diminuire la vitalità delle cellule senescenti, promuovendo la loro eliminazione. Effetto sul Microambiente Tessutale: Eliminando le cellule senescenti, la metformina potrebbe migliorare il microambiente tessutale, favorendo la funzione delle cellule staminali e la rigenerazione tessutale. Stress Ossidativo nelle Cellule Senescenti: La vitamina C, essendo un potente antiossidante, può influenzare il bilancio redox nelle cellule senescenti. In alcuni casi, può esacerbare lo stress ossidativo nelle cellule senescenti, portando alla loro morte. Influenza sull'Espressione Genica: La vitamina C può influenzare l'espressione genica delle cellule senescenti, potenzialmente attivando vie che portano alla loro eliminazione. Rinnovamento del Microambiente Cellulare: Rimuovendo le cellule senescenti, la vitamina C può contribuire al rinnovamento del microambiente cellulare, supportando la funzione e l'attività delle cellule staminali. Effetto Warburg: Si riferisce al fenomeno per cui le cellule, principalmente le cellule tumorali, tendono a metabolizzare il glucosio attraverso la glicolisi piuttosto che attraverso la fosforilazione ossidativa, anche in presenza di ossigeno. Relazione con la Senolisi: Non esiste una relazione diretta tra l'effetto Warburg e la senolisi. Tuttavia, i cambiamenti metabolici associati all'effetto Warburg possono influenzare la sopravvivenza e la funzione delle cellule senescenti. Implicazioni per le Cellule Staminali: Sebbene l'effetto Warburg non sia senolitico di per sé, i cambiamenti metabolici nelle cellule senescenti possono influenzare l'ambiente in cui si trovano le cellule staminali, potenzialmente influenzando la loro attivazione e funzione. Discussione: Implicazioni per la Medicina Rigenerativa: La comprensione del metabolismo glicolitico nelle cellule staminali è fondamentale per ottimizzare le strategie di coltura cellulare e migliorare l'efficienza della riprogrammazione delle cellule somatiche in cellule staminali pluripotenti. Sfide e Prospettive Future: Nonostante i progressi, rimangono questioni aperte riguardo alla regolazione precisa del metabolismo glicolitico e al suo impatto sul destino cellulare. Ulteriori ricerche sono necessarie per esplorare le connessioni tra il metabolismo glicolitico, la pluripotenza e la differenziazione. Conclusione: Il metabolismo glicolitico gioca un ruolo fondamentale nel mantenimento della pluripotenza delle cellule staminali. Questa caratteristica metabolica non solo fornisce l'energia necessaria per la sopravvivenza e la proliferazione delle cellule staminali, ma influisce anche sulla regolazione genica e sulla funzione cellulare. La comprensione approfondita di questi processi è cruciale per lo sviluppo di strategie efficaci nella medicina rigenerativa e nella terapia cellulare. Parole Chiave: Pluripotenza, Cellule Staminali, Metabolismo Glicolitico, Effetto Warburg, Medicina Rigenerativa, Terapia Cellulare. Approcci Dietetici
Approcci Farmacologici
Come la Metformina Induce l'Effetto Warburg
Cellule Più Sensibili alla Metformina
Riprogrammazione Metabolica con Metformina, VLCD, AAE, Vitamina C e Glutatione
Quali sono le cellule più sensibili all'Effetto della MwetforminaEffetti della Metformina sulle Cellule Staminali
Effetti della Vitamina C sulle Cellule Staminali
Sinergia e Interazioni
Metformina come Senolitico
Vitamina C come Senolitico
Effetto Warburg e Senolisi
© Gianluca Latino
"Il Metabolismo Glicolitico come Fondamento della Pluripotenza Cellulare: Sostegno Energetico per la Proliferazione e il Mantenimento delle Cellule Staminali"
"Il Metabolismo Glicolitico come Fondamento della Pluripotenza Cellulare: Sostegno Energetico per la Prolifera
2024-01-23 11:21
2024-01-23 11:21
Array() no author 82228
Medicina Rigenerativa - Metabolismo,