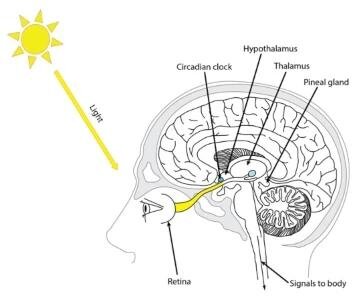
Come la regolazione dell'orologio circadiano dei metaboliti rivela l'accoppiamento tra trascrizione, metabolismo e gli amionoacidi La perturbazione genetica del gene CRY1 (Cromosoma 12), disaccoppia i ritmi trascrizionali e metaboliti, questo gene codifica per una proteina legante la flavina adenina dinucleotide che è un componente chiave del complesso oscillatore circadiano centrale, che regola l'orologio circadiano. Questo gene è sovraregolato dagli eterodimeri CLOCK/ARNTL, ma poi reprime questa sovraregolazione in un ciclo di feedback usando eterodimeri PER/CRY per interagire con CLOCK/ARNTL. I polimorfismi in questo gene sono stati associati a modelli di sonno alterati. L'intricata connessione tra l'orologio circadiano e il metabolismo rimane poco compresa. Nel fegato, ∼50% dei metaboliti ha un rittmo circadiano, con arricchimento di nucleotidi, amminoacidi e vie di metilazione. Nelle cellule OS U2, il 28% era circadiano, inclusi aminoacidi e metaboliti della biosintesi del NAD. 18 metaboliti oscillavano in entrambi i sistemi e un sottogruppo di questi negli epatociti primari. Questi 18 metaboliti sono stati arricchiti nelle vie di metilazione e aminoacidi. Per valutare la dipendenza dall'orologio di questi ritmi, si è evidenziato che la perturbazione genetica, con il knockdown di BMAL1 ha diminuito i ritmi dei metaboliti, mentre la perturbazione di CRY1 o CRY2 ha generalmente accorciato o allungato i ritmi, rispettivamente. Sorprendentemente, il knockdown di CRY1 ha indotto ritmi di 8 ore in aminoacidi, metilazione e metaboliti vitaminici, disaccoppiando il metabolita dai ritmi trascrizionali, con un potenziale impatto sul rilevamento dei nutrienti in vivo. Questi risultati forniscono le prime visioni complete del fegato circadiano e del metabolismo autonomo delle cellule. I ritmi circadiani in fisiologia e comportamento sono fondamentali per la maggior parte degli organismi. Nei mammiferi, l'interruzione dei ritmi circadiani porta a molte condizioni fisiopatologiche come: · disfunzioni cognitive, · disturbi psichiatrici, · cancro, · obesità, · insulino-resistenza, · sindrome metabolica · infiammazione (Albrecht, 2013, Altman et al., 2015, Antunes et al., 2010, Bechtold et al., 2010, Kawachi et al., 1995, Parkes, 2002, Reppert e Weaver, 2002, Sharifian et al., 2005). Lavori recenti mostrano che l'orologio circadiano è intimamente connesso al metabolismo e fa luce sulle vie metaboliche che sono potenzialmente sotto controllo circadiano (Asher e Schibler, 2011, Basso, 2012, Eckel-Mahan e Sassone-Corsi, 2013, Green et al., 2008, Papagiannakopoulos et al., 2016, Zhang et al., 2014, Zwighaft et al., 2015). I ritmi circadiani autonomi delle cellule sono generati attraverso una rete regolatrice trascrizionale di geni orologio. Nel core feedback loop, gli attivatori trascrizionali BMAL1 e CLOCK regolano i repressori trascrizionali Cryptochrome (Cry1 e Cry2) e Period (Per1 e Per2). Dopo la traduzione e la localizzazione nucleare, le proteine PER e CRY inibiscono la funzione BMAL1/CLOCK, portando all'espressione genica ritmica dell'intero genoma (incluso il proprio). In molti percorsi fisiologici, le fasi di limitazione della frequenza sono sotto il controllo dell'orologio circadiano. La mutazione genetica o la perturbazione ambientale (ad esempio, lavoro a turni o jet lag) interrompono la funzione dell'orologio e possono causare disturbi del sonno, cancro e malattie cardiovascolari e metaboliche. (Asher e Schibler, 2011, Basso e Takahashi, 2010, Green et al., 2008) Le perturbazioni genetiche hanno mostrato che la stragrande maggioranza di questo ciclo dipende da un orologio intatto. Sorprendentemente, il knockdown di CRY1 ha provocato la comparsa di metaboliti ritmici sia a 8 che a 32 ore, disaccoppiando le oscillazioni trascrizionali e metaboliche. Regolazione dell'orologio dei metaboliti epatici La maggior parte delle vie metaboliche del fegato ospitano passaggi controllati dall'orologio circadiano, spesso limitanti la chiave e la velocità. Lo studio dei geni del core clock ha confermato questo legame, poiché la mutazione di Clock o Bmal1 ha portato a profonde anomalie metaboliche nei topi (Rudic et al., 2004, Turek et al., 2005). L'interpretazione della modulazione acrofasica dei ritmi metabolici dà origine a una serie di "onde metaboliche" biologicamente rilevanti che si verificano durante il giorno circadiano. Ad esempio, è noto che il contenuto di glicogeno diurno raggiunge il picco tra CT 0 e CT 2 nei topi (Doi et al., 2010, Ishikawa e Shimazu, 1980, Roesler e Khandelwal, 1985). I nostri dati suggeriscono un'onda attraverso la quale la conversione del glicogeno in glucosio e il successivo ingresso nel ciclo dell'acido tricarbossilico (TCA) seguono rapidamente con glucosio e citrato che hanno fasi di picco di CT 2,5 e CT 1 ora, rispettivamente. Successivamente, l'altro ciclo intermedio TCA che mostra un ciclo significativo, malato, ha un'acrofase a TC 5,5 ore. Allo stesso modo, il ciclo del metabolita riflette i cambiamenti nello stato ossidativo della cellula con cambiamenti nei picchi dei metaboliti ossidativi. Ad esempio, le acrofasi opposte del glutatione e dell'ascorbato ridotti (CT 23,5 e CT 1,5) rispetto al FAD (CT 11,5). La FAD è nota come uno dei soli due metaboliti con acrofase vicino al crepuscolo, l'altro è il fenillattato. UDP-glucosio e la controparte ossidata UDP-glucuronato dimostrano anche acrofasi opposte di CT 6 e CT 18,5 ore, rispettivamente. Mentre alcuni di questi composti sono stati notati per avere oscillazioni circadiane nel fegato, questo è il primo atlante completo dei cambiamenti metabolici temporali nel tessuto epatico. Sono stati trovsati ∼15 metaboliti ciclici alla frequenza di 12 ore, una seconda armonica della frequenza circadiana. Questi metaboliti sono stati arricchiti per i membri del metabolismo degli aminoacidi aromatici e dei nucleotidi. Curiosamente, abbiamo anche trovato tre metaboliti ciclici alla frequenza di 8 ore, una terza armonica di periodicità circadiana, 2-idrossiglutarato, aconitato e NADH, tutti coinvolti nel metabolismo energetico. Questi risultati sono sorprendentemente simili ai precedenti risultati della trascrizione e della regolazione delle proteine (Ramsey et al., 2009). Queste armoniche dipendevano da un orologio intatto (Hughes et al., 2012), poiché le trascrizioni ritmiche di 12 ore sono diventate 24 ore quando la funzione dell'orologio è stata selettivamente ripristinata al cervello. Gaschon e colleghi hanno descritto ritmi di 12 ore nei livelli proteici per i componenti della risposta proteica spiegata (Ern1 / Ire1) e del reticolo endoplasmatico, con una dipendenza simile da un orologio intatto. Pertanto, come la trascrizione e la traduzione, le armoniche della frequenza circadiana sembrano essere un segno distintivo del ciclo dei metaboliti (Cretenet et al., 2010). Le analisi dei percorsi di questi dati mostrano una rete interconnessa costituita da metilazione, metabolismo monocarbonio, creatina e azoto. La maggior parte di questi metaboliti ciclo con acrofase vicino a CT 18 (colore giallo in figura), con le notevoli eccezioni di 5′-metiltioadenosina (MTA), S-adenosilmetionina (SAM) e creatina, che hanno acrofasi vicino a CT 4 (colore blu). SAM e MTA sono direttamente collegati tramite 5-adenosilmetionamina (non misurata in questo studio) e sono precursori nella metilazione a S-adenosilomocisteina (SAH). Questo percorso oscilla dopo la somministrazione di una dieta ricca di grassi (HFD) (Eckel-Mahan et al., 2013), che potrebbe essere un'amplificazione del ritmo endogeno rilevato nel nostro studio. La metilazione ha dimostrato di essere un processo di regolazione circadiano chiave attraverso le transizioni cromatiniche; ad esempio, la trimetilazione di Lys4 nell’istone H3 (Ripperger e Schibler, 2006). Ciclo del metabolita autonomo delle cellule Una caratteristica distintiva degli orologi circadiani è la loro capacità di segnare il passo indipendentemente da segnali esterni (Zeitgeibers) come: · luce, · sostanze nutritive, · ormoni · attività. Queste osservazioni sono coerenti con il fatto che i ritmi autonomi delle cellule, in cui le cellule sono separate dalla temperatura ritmica, dagli ormoni, dalla dieta e dall'attività, sono più deboli dei ritmi in vivo, dove questi segnali sono integrati e coerenti. La notevole discrepanza tra la percentuale di trascritti e metaboliti ciclici suggerisce il potente effetto che un numero limitato di geni ha sulla produzione metabolica cellulare complessiva, suggerendo un'amplificazione del controllo dell'orologio tra trascrizione, traduzione e funzione. Rimane da determinare il contributo relativo delle fasi nei livelli di enzimi e metaboliti, nonché le modifiche post-traduzionali. L'analisi dei metaboliti stessi dimostra il ciclo del panmetaboloma, con amminoacidi, metabolismo energetico e lipidico e cofattori enzimatici altamente rappresentati. Nel complesso, ciò suggerisce che in presenza di un orologio circadiano trascrizionale intatto, il metabolismo ciclizza anche con un periodo vicino alle 24 ore in assenza di zeitgeibers esterni con notevole coerenza in fase. I ritmi dei metaboliti autonomi delle cellule dipendono dall'orologio circadiano ma possono essere disaccoppiati in frequenza Questi risultati suggeriscono che i ritmi dei metaboliti cellulari dipendono in gran parte da un oscillatore trascrizionale intatto, ma possono esistere anche alcuni oscillatori metabolici indipendenti. È interessante notare che, mentre c'erano alcune armoniche di 8 ore in condizioni di controllo e nessuna armonica di 12 ore, la perturbazione di CRY1 ha portato ad un aumento dei metaboliti con un periodo di 8 ore (JTK q Questi metaboliti del ciclo ultradiano includevano un'abbondanza di aminoacidi: · arginina, · metionina, · tirosina, · valina, · triptofano, · leucina · isoleucina · prodotti di metilazione (dimetilarginina e dimetilglicina) · vitamina B1 (tiamina). Il ciclo nello stato ossidativo delle cellule era anche più pronunciato nelle cellule knockdown CRY1 e CRY2 rispetto al knockdown BMAL1, misurato dal rapporto di conta ionica di NAD + / NADH. L'analisi del percorso dei metaboliti del ciclo knockdown di controllo e CRY1/CRY2 dimostra che, nel complesso, entrambe le perturbazioni di Cry influenzano vie metaboliche simili rispetto al controllo, ma esacerbano l'effetto ciclico in particolare in percorsi come: · il metabolismo centrale del carbonio, · l'omeostasi del glucosio · il metabolismo del glutatione. Questo risultato evidenzia la connessione tra l'orologio e il metabolismo energetico e dello stress ossidativo. Le conseguenze metaboliche della perdita di Cry1 implicano effetti sul rilevamento dei nutrienti All'interno di questo gruppo, un certo numero di aminoacidi sono stati notati come elevati, tra cui Arg, Ser, Asp, Val, Leu / Ile, Trp, Tyr, His e Thr, così come derivati aminoacidici come N6-acetillisina e dimetilarginina. Questo modello corrisponde a una sovrarappresentazione di aminoacidi con un ciclo di 8 ore sotto knockdown Cry1. Ci sono 34 metaboliti ciclici con q La sovrarappresentazione del metabolismo degli aminoacidi sia nell'analisi ciclica che in quella differenziale ci ha portato a ragionare che la perturbazione di Cry1 e il disaccoppiamento trascrizionale/metabolico correlato osservato avrebbero avuto un impatto in vivo sul rilevamento dei nutrienti. I due risultati più significativi di JTK sono la dimetilarginina e arginina, l’analisi dei metaboliti ha rivelato che l'Arg era elevato nel Cry1−/− genotipo (FDR Analogamente, si è notato che il Gln è stato ridotto indipendentemente dal tempo. La dimetilarginina ha dimostrato un cambiamento dipendente dal tempo, così come l'UMP, un prodotto finale della sintesi nucleotidica de novo che ha dimostrato essere regolato da mTOR (Ben-Sahra et al., 2013, Robitaille et al., 2013). È noto che alterazioni nei livelli di Arg influiscono sulla segnalazione mTOR tramite CASTOR1 (Chantranupong et al., 2016), e quindi esaminando i target mTOR a valle e notato una consistente sovraregolazione dell'attivazione del pathway mTOR in CRY1−/− fegati di topo rispetto ai topi di controllo (che erano complessivamente più eterogenei), in particolare a ZT10. Gli studi hanno rilevato una serie di 18 metaboliti ciclici che oscillano tra tessuti e tipi di cellule e tra esseri umani e topi, questi sono i "metaboliti multi-ciclo" (MCM) e suggeriamo che siano regolati dalle uscite primarie dell'orologio. Questo set è costituito da aminoacidi: · L-arginina, · L-istidina, · L-prolina, · L-metionina, · L-glutammato · L-glicina), · vitamine e cofattori (1-metilnicotinamide e nicotinamide), · composti correlati ai lipidi (fosfocolina, glicerofosfocolina, butirrilcarnitina e acido L-malico), · composti di metilazione (SAH e MTA), · glutatione ossidato, · uridina difosfato glucosio (UDP-glucosio), · taurina · citidina monofosfato (CMP). Questi MCM erano sovrarappresentati per i componenti del metabolismo della cisteina e della metionina oltre al metabolismo dei glicerofosfolipidi, dell'istidina e del nicotinato e della nicotinammide. Quattro dei metaboliti (L-arginina, MTA, SAH e L-metionina) erano contenuti nella via interconnessa, con tre di essi strettamente correlati nella fase critica di metilazione. Alcuni di questi MCM possono avere funzioni di clock attraverso azioni sulla metilazione dell'RNA o sulla cromatina; ad esempio, la glicosilazione derivata dal glucosio UDP o la metilazione a code istoniche (Eckel-Mahan e Sassone-Corsi, 2013). Questi metaboliti possano svolgere un ruolo nella regolazione epigenetica. Le interazioni degli orologi trascrizionali e metabolici influenzano le molecole coinvolte nella metilazione, nello stress ossidativo e nella glicosilazione, che sono state dimostrate da molti altri per svolgere un ruolo nei meccanismi epigenetici. L'alimentazione e la tempistica dell'assunzione di cibo possono essere viste come un input nell'orologio biologico (Damiola et al., 2000) nonché una proprietà controllata dall'orologio, l'influenza dell'alimentazione sul metaboloma è una proprietà circadiana in sé e per sé. 





© Gianluca Latino
Come la regolazione dell'orologio circadiano dei metaboliti rivela l'accoppiamento tra trascrizione, metabolismo e gli amionoacidi
Come la regolazione dell'orologio circadiano dei metaboliti rivela l'accoppiamento tra trascrizione, metabolis
2023-05-09 15:27
2023-05-09 15:27
Array() no author 82228
Metabolismo,