Capitolo 1 — Origini e Storia del Concetto di Ormesi
1.1. Etimologia e radici storiche
Il termine ormesi deriva dal greco hormáein, che significa “mettere in movimento”, “stimolare”. Questa etimologia riflette perfettamente il nucleo concettuale: un piccolo stimolo che innesca una risposta positiva. L’uso scientifico del termine si è consolidato nel XX secolo, ma le osservazioni empiriche risalgono a epoche antiche. Nella medicina ippocratica e in quella tradizionale cinese si riconosceva che “ciò che non uccide fortifica”, un principio embrionale dell’ormesi.
1.2. Prime osservazioni tossicologiche
Nei secoli XVII e XVIII, in farmacologia e tossicologia si notò che alcune sostanze tossiche, in dosi minime, avevano effetti terapeutici. Paracelso, con il famoso adagio “la dose fa il veleno”, anticipò la comprensione moderna della curva dose-risposta. Gli studi di Hugo Schulz e Rudolf Arndt nell’Ottocento misero in evidenza che piccole dosi di tossici stimolavano la crescita microbica, mentre dosi elevate la inibivano: nasce così la cosiddetta legge di Arndt-Schulz, antesignana dell’ormesi.
1.3. Dalla tossicologia alla biologia moderna
Nel XX secolo il concetto si amplia: l’ormesi non riguarda solo tossici chimici, ma tutti gli stressor biologici, fisici e ambientali. Dagli anni ’80, grazie a Edward Calabrese e Mark Mattson, l’ormesi si afferma come modello biologico generale, integrando biologia cellulare, neuroscienze, gerontologia e scienze ambientali. Oggi è riconosciuta come un principio unificante che attraversa discipline diverse, dalla medicina rigenerativa alla farmacologia preventiva.
1.4. Evoluzione concettuale nel XXI secolo
Con l’avvento della medicina di precisione e dei big data, l’ormesi è stata riconsiderata come chiave per personalizzare interventi preventivi e terapeutici. Non più solo fenomeno tossicologico, ma strategia per:
- Estendere la salute metabolica.
- Potenziare la resilienza neurologica.
- Favorire la longevità attraverso stress controllati.
- Integrare sport, dieta, fitonutrienti e tecnologia.
1.5. Sintesi storica
Dalle intuizioni empiriche ippocratiche alla sistematizzazione tossicologica, fino alle moderne applicazioni cliniche, l’ormesi rappresenta una delle rare idee trasversali capaci di unificare la medicina in un continuum storico.
Capitolo 2 — Meccanismi Molecolari e Cellulari dell’Ormesi
2.1. Fondamenti molecolari
L’ormesi si basa sull’attivazione di vie molecolari conservate evolutivamente. Tra i principali meccanismi:
- NRF2/ARE: fattore di trascrizione che regola geni antiossidanti (HO-1, NQO1, GCLC).
- Sirtuine (SIRT1-7): deacetilasi NAD-dipendenti, implicate in longevità, metabolismo e resilienza cellulare.
- AMPK/mTOR: sensori energetici che bilanciano crescita e catabolismo.
- HIF-1α: stabilizzato da ipossia, induce angiogenesi e adattamento metabolico.
2.2. Risposta allo stress proteico
- HSP (Heat Shock Proteins): funzionano da chaperoni molecolari, aiutando il folding proteico corretto e prevenendo aggregati tossici.
- UPR (Unfolded Protein Response): risposta dell’ER che adatta la cellula a stress proteotossici.
2.3. Autofagia e controllo qualità
- Autofagia: processo di riciclo di organelli danneggiati.
- Mitofagia: eliminazione mitocondri difettosi.
- Proteasoma: degradazione proteine ossidate.
2.4. Metabolismo energetico adattativo
- Biogenesi mitocondriale (via PGC-1α).
- Ketogenesi: substrati alternativi in digiuno.
- Flessibilità metabolica: passaggio glucosio ↔ lipidi.
2.5. Interazione ROS e segnali adattativi
Un aspetto cruciale dell’ormesi è il ruolo dei ROS (specie reattive dell’ossigeno). In eccesso, provocano danno ossidativo; in piccole quantità, fungono da secondi messaggeri attivando vie pro-riparative (NRF2, mitogen-activated kinases). Questo concetto, detto mito-ormesi, spiega come l’esercizio fisico e il digiuno inducano benefici tramite stress ossidativo moderato.
2.6. Modelli sperimentali e evidenze
- Colture cellulari esposte a H₂O₂ mostrano aumento di enzimi antiossidanti a basse dosi.
- Animali sottoposti a ipossia intermittente sviluppano angiogenesi cerebrale.
- Umani in protocolli di digiuno intermittente presentano aumento autofagia e sensibilità insulinica.
2.7. Sintesi meccanicistica
L’ormesi non è un singolo pathway, ma una rete di risposte integrate che bilanciano danno e protezione. La finestra ormetica si colloca tra dose insufficiente (nessun effetto) e dose eccessiva (tossicità), e varia tra individui in base a genetica, età e stato di salute.
Capitolo 3 — Meccanismi Tissutali e Sistemici
3.1. Livello tissutale
Gli effetti ormetici si traducono in adattamenti specifici nei diversi tessuti:
- Cuore: precondizionamento ischemico, aumento resistenza a infarto, riduzione del danno da riperfusione.
- Cervello: neurogenesi, plasticità sinaptica, tolleranza a ischemie transitorie.
- Muscolo scheletrico: aumento mitocondri, riduzione accumulo lattato, miglioramento forza e resistenza.
- Cute: stimolo fibroblasti, aumento collagene ed elastina, resilienza cutanea.
3.2. Livello sistemico
- Sistema cardiovascolare: angiogenesi, miglioramento funzione endoteliale.
- Sistema nervoso: stimolazione BDNF, resilienza contro neurodegenerazione.
- Sistema immunitario: regolazione bilanciata tra risposta innata e adattativa, riduzione infiammazione cronica.
- Sistema metabolico: miglioramento sensibilità insulinica, attivazione BAT (tessuto adiposo bruno).
3.3. Effetto ormetico sulla longevità
Gli organismi esposti ciclicamente a stress controllati presentano aumento della healthspan (periodo di vita in salute). Studi su modelli animali mostrano estensione della vita media attraverso digiuno, esercizio e restrizione calorica.
3.4. Finestra terapeutica sistemica
La finestra ormetica varia per tessuto e sistema. Ad esempio:
- Nel cuore: ischemia breve e controllata è protettiva, ischemia prolungata è letale.
- Nel cervello: ipossia lieve stimola neuroplasticità, ipossia severa causa necrosi neuronale.
Capitolo 4 — Stressor Principali
4.1. Ischemia Terapeutica
- Definizione: induzione di ischemia transitoria controllata (locale o remota).
- Meccanismi: rilascio di adenosina, NO, ROS lievi, HSP, fattori angiogenici.
- Applicazioni: cardioprotezione peri-operatoria, riduzione danno da infarto, neuroprotezione sperimentale.
- Rischi: se mal dosata, può causare necrosi o aritmie.
4.1.1 Condizionamento Ischemico Remoto (RIC)
Definizione
Il Condizionamento Ischemico Remoto (RIC) è una tecnica non invasiva che utilizza cicli ripetuti di ischemia-riperfusione indotti su un arto (es. gonfiaggio e sgonfiaggio di un manicotto pressorio) per stimolare meccanismi di protezione sistemica.
Meccanismi Biologici
Vie umorali e neuronali: rilascio di ossido nitrico, microRNA-144 e segnali mitocondriali.
Risposta antiossidante: upregolazione di enzimi come SOD e catalasi.
Adattamento cellulare: aumento tolleranza a ipossia e stress infiammatorio.
Applicazioni Cliniche
Cardiologia: riduzione danno miocardico peri-operatorio, miglioramento funzione endoteliale.
Neurologia: neuroprotezione post-ictus se avviato entro 48 ore, incremento neuroplasticità.
Performance sportiva: aumento VO₂max, riduzione lattato, recupero muscolare più rapido.
Multiorgano: protezione di fegato e reni in setting chirurgici o critici.
Protocollo Standard
4 cicli di ischemia-riperfusione: gonfiaggio a ~200 mmHg per 5 minuti, seguito da 5 minuti di sgonfiaggio. Totale: ~40 minuti.
Vantaggi
Sicurezza: tecnica a basso rischio, eseguibile anche a domicilio.
Accessibilità: richiede solo un dispositivo pressorio.
Traslazionalità: adatta a pazienti, anziani, atleti e soggetti sani.
Prospettive Future
Dispositivi intelligenti: cuffie automatiche integrate con sensori biometrici.
Personalizzazione: identificazione di biomarcatori per dosi e frequenze individualizzate.
Estensione terapeutica: sperimentazioni in oncologia, geriatria e medicina rigenerativa.
4.2. Digiuno e Restrizione Calorica
- Digiuno intermittente: 16:8, 5:2, FMD.
- Restrizione calorica: riduzione apporto 20–30%.
- Meccanismi: attivazione AMPK, sirtuine, autofagia; riduzione IGF-1.
- Benefici: miglioramento metabolismo glucidico, protezione neuronale, longevità.
4.3. Ipossia Intermittente
- Definizione: esposizione ciclica a bassi livelli di O₂.
- Meccanismi: stabilizzazione HIF-1α, rilascio VEGF, aumento eritropoietina.
- Applicazioni: riabilitazione respiratoria, allenamento in quota, resilienza cerebrale.
- Limiti: rischio ipossiemia severa in soggetti fragili.
4.4. Stress Termico
- Caldo: sauna, bagni termali. Induce HSP, vasodilatazione.
- Freddo: crioterapia, immersioni in acqua fredda. Attiva BAT, aumenta metabolismo.
- Benefici: recupero muscolare, immunomodulazione, resilienza cutanea.
4.5. Sport come Stress Ormetico
- Esercizio aerobico: induce ROS fisiologici, stimola enzimi antiossidanti.
- HIIT (High-Intensity Interval Training): stimolo mitocondriale, aumento VO₂max.
- Periodizzazione: alternanza carico-recupero per evitare sovraccarico.
- Benefici: cardioprotezione, neuroplasticità, miglioramento metabolismo.
4.6. Dieta, Fitocomposti e Strategie Integrate
- Resveratrolo: polifenolo presente nell’uva e nel vino rosso, attiva SIRT1 e mima gli effetti della restrizione calorica. Associato a miglioramento della funzione mitocondriale e potenziale effetto anti-aging.
- Curcumina: pigmento estratto dalla curcuma, modula NF-κB con attività antinfiammatoria e antiossidante, utile in prevenzione di patologie croniche.
- Sulforafano: isotiocianato derivato da crucifere, potente induttore di NRF2, stimola la detossificazione e la protezione contro stress ossidativi.
- Restrizione aminoacidica: limitazione di metionina e BCAA riduce l’attivazione di mTOR, stimola autofagia e promuove resilienza metabolica.
- Restrizione calorica: riduce markers di senescenza cellulare e infiammazione cronica di basso grado, contribuendo ad aumentare la longevità.
- Esercizio moderato: agisce come stress ormetico fisiologico, preserva massa muscolare e autonomia funzionale in età avanzata.
- Cicli combinati (dieta + sport + sauna): approccio multimodale che incrementa healthspan e riduce fragilità.
Capitolo 5 — La Curva Dose-Risposta: Teoria, Modelli Matematici ed Evidenze
5.1. Fondamenti teorici
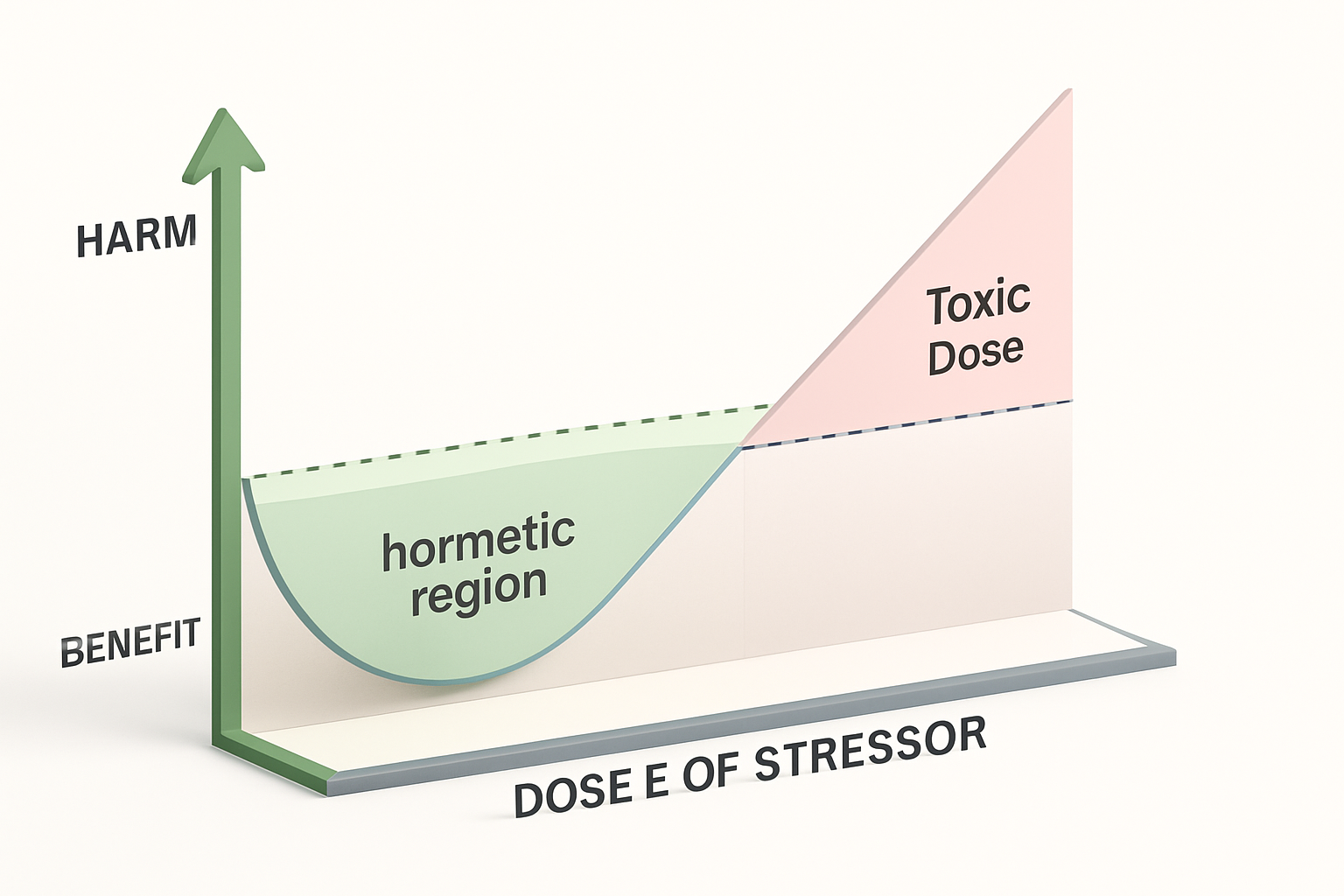
La risposta ormetica si rappresenta con una curva a U o J. In ascissa (X) si colloca l’intensità dello stimolo, in ordinata (Y) la risposta biologica. A basse dosi si osserva un miglioramento della funzione; superata una soglia critica, l’effetto diventa negativo.
5.2. Modelli matematici
- Modello lineare con soglia: Y = aX per X ≤ X₀; Y = bX per X > X₀.
- Modello logistico bifasico: Y = (Ymax / (1 + e^(−k(X−X₁)))) − (Ytox / (1 + e^(−k(X−X₂)))).
- Modello probabilistico: definisce la finestra ormetica come intervallo di massima probabilità di risposta adattativa.
5.3. Variabili individuali
La posizione della finestra ormetica varia con:
- Età (anziani → finestra ristretta).
- Genotipo (polimorfismi NRF2, SIRT).
- Stato nutrizionale e comorbilità.
5.4. Evidenze sperimentali
- Esercizio fisico: miglioramento capacità aerobica a intensità moderate; danno muscolare a intensità eccessive.
- Digiuno: benefici cognitivi con 16–24 ore; rischio catabolico oltre 72 ore senza supporto.
- Ischemia: cardioprotezione con cicli brevi; necrosi con ischemia prolungata.
5.5. Implicazioni cliniche
La curva dose-risposta consente di definire protocolli terapeutici sicuri. La chiave è stabilire la “dose ottimale” di stressor, adattata al paziente.
Capitolo 6 — Applicazioni Cliniche per Specialità
6.1. Cardiologia
- Precondizionamento ischemico remoto: riduzione infarti peri-operatori.
- HIIT e allenamento aerobico: miglioramento funzione endoteliale, aumento VO₂max.
- Restrizione calorica: riduzione pressione arteriosa e markers infiammatori.
6.2. Neurologia
- Esercizio aerobico: aumento BDNF, neurogenesi ippocampale.
- Ipossia intermittente: resilienza neuronale e angiogenesi cerebrale.
- Digiuno intermittente: stimolo autofagia neuronale, protezione contro Alzheimer e Parkinson.
6.3. Endocrinologia e Metabolismo
- Time-restricted feeding: miglioramento sensibilità insulinica.
- Freddo controllato: attivazione BAT, aumento consumo energetico.
- Fitocomposti: resveratrolo e curcumina come mimetici di restrizione calorica.
6.4. Dermatologia e Medicina Estetica
- Stress cutanei moderati (laser frazionato, microneedling): stimolo collagene.
- Crioterapia locale: miglioramento circolazione cutanea.
- Fitocomposti topici: antiossidanti naturali per resilienza cutanea.
6.5. Geriatria e Longevità
- Restrizione calorica: riduzione markers di senescenza.
- Esercizio moderato: mantenimento massa muscolare e autonomia.
- Cicli combinati (dieta + sport + sauna): aumento healthspan.
6.6. Oncologia (ambiti sperimentali)
- Digiuno intermittente: riduce tossicità della chemioterapia, protegge cellule sane e sensibilizza cellule tumorali.
- Ipossia intermittente: modulazione angiogenesi tumorale e aumento efficacia terapeutica di alcuni farmaci.
- Stress ossidativo controllato: impiegato come strategia per sensibilizzare cellule tumorali alle terapie convenzionali, limitando la resistenza farmacologica.
Capitolo 7 — Biomarcatori e Strumenti di Monitoraggio
7.1. Biomarcatori molecolari
- Proteine da stress: HSP70, HSP27, indice di attivazione HSP come marcatore precoce.
- Antiossidanti endogeni: SOD, catalasi, glutatione perossidasi.
- Target NRF2: HO-1, NQO1, GCLC.
- Autofagia: LC3-II/I ratio, p62.
- Metaboliti: lattato, corpi chetonici, NAD+/NADH.
7.2. Biomarcatori funzionali
- HRV (Heart Rate Variability): equilibrio autonomico.
- VO₂max: capacità aerobica.
- Test di tolleranza al glucosio: sensibilità insulinica.
- Funzione endoteliale: FMD (Flow Mediated Dilation).
7.3. Biomarcatori clinici
- Infiammazione sistemica: PCR, IL-6, TNF-α.
- Longevità biologica: orologi epigenetici (methylation clocks).
- Fragilità geriatrica: scale cliniche integrate.
7.4. Strumenti digitali
- Wearables: monitoraggio continuo HR, SpO₂, temperatura.
- App mobili: tracciamento digiuno, attività fisica, sonno.
- AI predittive: analisi pattern e adattamento protocolli.
7.5. Stratificazione prognostica
- Genomica: polimorfismi SIRT, NRF2, FOXO.
- Metabolomica: profilo substrati energetici.
- Microbioma: produzione di metaboliti ormetici (es. butirrato).
Capitolo 8 — Implementazione Clinica e Personalizzazione
8.1. Struttura dei protocolli
- Assessment iniziale: anamnesi, biomarcatori, fragilità.
- Inizio graduale: esposizione a basso dosaggio.
- Titolazione: aumento progressivo intensità/durata.
- Mantenimento: cicli regolari e personalizzati.
8.2. Personalizzazione e precision medicine
- Genetica: SNP su NRF2, SIRT1.
- Epigenetica: orologi biologici per dosare protocolli.
- Fenotipo clinico: età, comorbilità, resilienza.
8.3. Integrazione digitale
- Wearables: monitoraggio in real time.
- AI: predizione risposta individuale.
- Telemedicina: follow-up a distanza.
8.4. Sicurezza e linee guida
- Parametri vitali: BP, HR, SpO₂.
- Soglie di allarme: HRV ↓ >20%, lattato ↑ eccessivo.
- Criteri di sospensione: sintomi acuti, marcatori fuori range.
8.5. Applicazione pratica nei centri clinici
- Cardiologia: ischemia terapeutica controllata.
- Neurologia: ipossia e sport adattati.
- Geriatria: cicli integrati di digiuno e attività.
- Dermatologia: stress cutanei guidati.
8.6. Formazione professionale
- Competenze necessarie: fisiologia dello stress, biomarcatori.
- Certificazioni: programmi di specializzazione.
- Aggiornamento continuo: trial clinici e linee guida.
8.7. Equità e accessibilità
- Riduzione disuguaglianze: accesso universale.
- Standardizzazione: protocolli validati e replicabili.
- Sostenibilità: modelli economici costo-efficacia.
Capitolo 9 — Etica, Limiti e Considerazioni Critiche
9.1. Questioni etiche
- Consenso informato: i pazienti devono comprendere rischi e benefici dell’esposizione a stress controllati.
- Equità di accesso: il rischio è che le terapie ormetiche diventino privilegio di pochi.
- Uso estetico vs medico: differenziare applicazioni cliniche validate da pratiche commerciali non regolamentate.
9.2. Limiti scientifici
- Evidenze cliniche incomplete: mancano trial randomizzati di lungo termine.
- Variabilità individuale: la finestra ormetica cambia da persona a persona.
- Traslazione difficile: dai modelli animali all’uomo ci sono gap significativi.
9.3. Rischi potenziali
- Sovradosaggio di stress: transizione da adattamento a danno.
- Popolazioni vulnerabili: anziani fragili, pazienti oncologici, donne in gravidanza.
- Interazioni farmacologiche: rischio di interferenza con terapie convenzionali.
9.4. Regolamentazione
- Necessità di linee guida internazionali.
- Standardizzazione protocolli e dosaggi.
- Validazione tramite registri clinici e audit indipendenti.
Capitolo 10 — Prospettive Terapeutiche Emergenti e Direzioni Future
10.1. Innovazioni tecnologiche
- Camere ambientali integrate: esposizione programmata a calore, freddo, ipossia.
- Gemelli digitali: simulazioni personalizzate di risposta ormetica.
- Wearables evoluti: monitoraggio continuo di HRV, lattato, SpO₂.
10.2. Farmacomimetici ormetici
- Attivatori NRF2: molecole per stimolare difese antiossidanti.
- Agonisti SIRT1: resveratrolo, spermidina, NAD+ precursori.
- Modulatori AMPK/mTOR: metformina, rapamicina a dosi micro.
10.3. Approcci combinatori
- Sport + dieta + fitocomposti: protocolli multimodali per amplificare benefici.
- Precondizionamento tissutale: preparare organi a stress chirurgici o trapianto.
- Mind-body integration: mindfulness come stress positivo controllato.
10.4. Medicina rigenerativa
- Priming cellulare: esposizione di cellule staminali a stress ormetici per aumentarne la resilienza.
- Terapia dei tessuti: ischemia remota per migliorare outcome chirurgici.
- Invecchiamento sano: cicli ormetici per mantenere organi funzionali.
10.5. Visione futura
L’ormesi può diventare pilastro della medicina del XXI secolo:
- Da curare la malattia a rafforzare la resilienza.
- Da protocollo uniforme a personalizzazione totale.
- Da intervento clinico a stile di vita guidato scientificamente.
- . 2009.
- Mattson MP. Hormesis defined. Ageing Res Rev. 2008.
- Southam CM, Ehrlich J. Effect of extracts of western red-cedar heartwood on certain wood-decaying fungi in culture. Phytopathology. 1943.
Capitolo 11 — Implementazione nei Sistemi Sanitari, Formazione ed Economia della Salute
11.1. Integrazione nei sistemi sanitari
- Prevenzione primaria: inserimento di digiuno intermittente, attività fisica e protocolli di stress controllato all’interno delle linee guida nazionali di salute pubblica.
- Medicina specialistica: avvio di programmi pilota in cardiologia, neurologia e oncologia per valutare efficacia clinica e sicurezza.
- Centri dedicati: istituzione di unità ospedaliere di Stress Medicine con équipe multidisciplinari.
11.2. Formazione professionale
- Competenze richieste: conoscenza di fisiologia dello stress, interpretazione di biomarcatori e gestione di protocolli clinici.
- Programmi di specializzazione: sviluppo di fellowship accademiche in medicina ormetica e rigenerativa.
- Educazione continua: aggiornamenti ECM periodici basati sulle più recenti evidenze scientifiche.
11.3. Modelli economici
- Analisi costo-efficacia: prevenzione e gestione delle malattie croniche come leva per ridurre la spesa sanitaria.
- ROI sanitario: diminuzione di ricoveri, prescrizioni farmacologiche e complicanze correlate.
- Investimenti mirati: strutture per termoterapia, camere ipossiche e sistemi di monitoraggio digitale.
11.4. Politiche di rimborso
- Outcome-based care: rimborsi vincolati al raggiungimento di risultati clinici misurabili.
- Nuova codifica: aggiornamento dei sistemi ICD e DRG per includere specifiche terapie ormetiche.
- Collaborazioni pubblico-privato: modelli di implementazione sostenibili basati su partnership.
11.5. Impatto sociale
- Riduzione disuguaglianze: garantire l’accesso a protocolli anche per popolazioni vulnerabili.
- Educazione sanitaria: promozione culturale del concetto di stress benefico come risorsa di salute.
- Longevità attiva: sostegno all’autonomia della popolazione anziana e riduzione della fragilità geriatrica.
Capitolo 12 — Bibliografia
12.1. Fondamenti teorici e tossicologia
- Calabrese EJ, Baldwin LA. Hormesis: the dose-response revolution. Annu Rev Pharmacol Toxicol. 2003.
- Calabrese EJ, Mattson MP. Hormesis as a biological hypothesis. Environ Health Perspect. 2009.
- Mattson MP. Hormesis defined. Ageing Res Rev. 2008.
- Southam CM, Ehrlich J. Effect of extracts of western red-cedar heartwood on certain wood-decaying fungi in culture. Phytopathology. 1943.
12.2. Meccanismi molecolari
- Ristow M, Zarse K. How increased oxidative stress promotes longevity. Exp Gerontol. 2010.
- Hekimi S, et al. ROS as signaling molecules in health and disease. Nat Rev Mol Cell Biol. 2011.
- López-Otín C, et al. The hallmarks of aging. Cell. 2013.
- Maiese K. Targeting sirtuins to treat complex diseases. Expert Opin Ther Targets. 2020.
12.3. Esercizio fisico e sport
- Radak Z, et al. Exercise, oxidative stress and hormesis. Ageing Res Rev. 2008.
- Gibala MJ, McGee SL. Metabolic adaptations to interval training. J Physiol. 2008.
- Powers SK, Jackson MJ. Exercise-induced oxidative stress. Physiol Rev. 2008.
- Zimmet P, et al. Exercise and global health. Lancet. 2019.
12.4. Digiuno e dieta
- Longo VD, Anderson RM. Nutrition, longevity and disease. Cell. 2022.
- de Cabo R, Mattson MP. Intermittent fasting. N Engl J Med. 2019.
- Brandhorst S, Longo VD. Fasting and periodic diets. Trends Endocrinol Metab. 2016.
12.5. Stress termici e ipossia
- Laukkanen T, et al. Sauna bathing and cardiovascular health. Mayo Clin Proc. 2018.
- Serebrovskaya TV, Xi L. Intermittent hypoxia training. Exp Biol Med. 2016.
- Tipton MJ. Cold water immersion: mechanisms and applications. Exp Physiol. 2019.
12.6. Applicazioni cliniche
- Hausenblas HA, et al. Hormetic effects in dermatology. J Dermatol Sci. 2015.
- Dirnagl U, et al. Ischemic preconditioning in stroke. Lancet Neurol. 2009.
- Eefting F, et al. Ischemic preconditioning in cardiology. Circulation. 2004.
- Cramer SC. Neuroplasticity and rehabilitation. Lancet Neurol. 2021.
12.7. Oncologia e sperimentazioni
- Raffaghello L, Longo VD. Fasting and cancer therapy. Sci Transl Med. 2010.
- Koong AC, et al. Targeting hypoxia in cancer therapy. Nat Rev Clin Oncol. 2014.
- Madeo F, Kroemer G. Essential role for autophagy in life span extension. J Clin Invest. 2009.
12.8. Bibliografia estesa aggiuntiva
Stress ossidativo e ROS 26. Hekimi S, Lapointe J, Wen Y. Taking a “good” look at free radicals in the aging process. Trends Cell Biol. 2011. 27. Sena LA, Chandel NS. Physiological roles of mitochondrial reactive oxygen species. Mol Cell. 2012. 28. Zorov DB, Juhaszova M, Sollott SJ. Mitochondrial ROS and cardiac pathophysiology. Circ Res. 2014. 29. Sies H. Oxidative stress: a concept in redox biology and medicine. Redox Biol. 2015. 30. Finkel T. Signal transduction by reactive oxygen species. J Cell Biol. 2011.
mTOR, AMPK e metabolismo 31. Laplante M, Sabatini DM. mTOR signaling in growth control and disease. Cell. 2012. 32. Hardie DG. AMPK: a key regulator of energy balance. Nat Rev Mol Cell Biol. 2015. 33. Saxton RA, Sabatini DM. mTOR signaling in growth, metabolism, and disease. Cell. 2017. 34. Yuan HX, Xiong Y, Guan KL. Nutrient sensing, metabolism, and cell growth control. Mol Cell. 2013. 35. Shimobayashi M, Hall MN. Making new contacts: the mTOR network in metabolism and signalling crosstalk. Nat Rev Mol Cell Biol. 2014.
Sirtuine e longevità 36. Guarente L. Sirtuins as regulators of ageing and longevity. Nat Rev Mol Cell Biol. 2013. 37. Cantó C, Auwerx J. NAD+ as a signaling molecule modulating metabolism. Cold Spring Harb Symp Quant Biol. 2011. 38. Gomes AP, et al. Declining NAD+ induces a pseudohypoxic state. Cell. 2013. 39. Imai S, Guarente L. NAD+ and sirtuins in aging and disease. Trends Cell Biol. 2014. 40. Bonkowski MS, Sinclair DA. Slowing ageing by design: the rise of NAD+ and sirtuin-activating compounds. Nat Rev Mol Cell Biol. 2016.
Microbioma e resilienza 41. Lynch SV, Pedersen O. The human intestinal microbiome in health and disease. N Engl J Med. 2016. 42. Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation. Cell. 2014. 43. Sharon G, et al. The central nervous system and the gut microbiome. Cell. 2016. 44. Zmora N, et al. Personalized nutrition by prediction of glycemic responses. Cell. 2015. 45. Valdes AM, Walter J, Segal E, Spector TD. Role of the gut microbiota in nutrition and health. BMJ. 2018.
Clinica geriatrica e fragilità 46. Fried LP, et al. Frailty in older adults: evidence for a phenotype. J Gerontol A. 2001. 47. Rockwood K, Mitnitski A. Frailty in relation to the accumulation of deficits. J Gerontol A. 2007. 48. Kennedy BK, et al. Geroscience: linking aging to chronic disease. Cell. 2014. 49. López-Otín C, Kroemer G. Hallmarks of health. Cell. 2021. 50. Ferrucci L, Fabbri E. Inflammageing: chronic inflammation in ageing, cardiovascular disease, and frailty. Nat Rev Cardiol. 2018.
Biohacking controllato e lifestyle medicine 51. Asprey D. Head Strong: The Bulletproof Plan to Activate Untapped Brain Energy. HarperCollins, 2017. 52. Seitz BM, et al. Hormesis, stress, and resilience in the modern environment. Front Med. 2019. 53. González-García I, et al. Intermittent fasting, hormesis and health. Ageing Res Rev. 2020. 54. O’Keefe JH, Lavie CJ. Exercise and cardiovascular health: dose-response. Mayo Clin Proc. 2018. 55. Mattson MP. An evolutionary perspective on why food restriction increases longevity. Mech Ageing Dev. 2005.
Policy sanitarie e implementazione 56. Kickbusch I, et al. Health governance: the health society. Lancet. 2016. 57. WHO. Global strategy and action plan on ageing and health. Geneva, 2017. 58. Bloom DE, et al. The global economic burden of non-communicable diseases. Geneva: World Economic Forum, 2011. 59. Beard JR, et al. Global ageing and health: the need for an integrative approach. Lancet. 2016. 60. Horton R. Offline: Planetary health and human health. Lancet. 2017.
Fontana L, Partridge L, Longo VD. Extending healthy life span—from yeast to humans. Science. 2010.
Mattson MP, Moehl K, Ghena N, Schmaedick M, Cheng A. Intermittent metabolic switching, neuroplasticity and brain health. Nat Rev Neurosci. 2018.
Demasi M, et al. Redox regulation of proteostasis in health and disease. Nat Rev Mol Cell Biol. 2021.
Barja G. Free radicals and aging. Trends Neurosci. 2004.
Rattan SIS. Hormesis in aging. Ageing Res Rev. 2008.
Speakman JR, Mitchell SE. Caloric restriction. Mol Aspects Med. 2011.
Di Francesco A, Di Germanio C, Bernier M, de Cabo R. A time to fast. Sci Transl Med. 2018.
Epel ES, Lithgow GJ. Stress biology and aging mechanisms: toward understanding the deep connection between adaptation to stress and longevity. J Gerontol A. 2014.
Kirkwood TBL. A systematic look at an old problem. Nature. 2008.
Johnson JB, et al. Alternate day fasting improves markers of general health. Free Radic Biol Med. 2007.
Caristia S, et al. Intermittent fasting and cardiometabolic health. Nutrients. 2020.
Antoni R, Johnston KL, Collins AL, Robertson MD. Effects of intermittent fasting on glucose and lipid metabolism. Proc Nutr Soc. 2017.
Patterson RE, Sears DD. Metabolic effects of intermittent fasting. Annu Rev Nutr. 2017.
Sutton EF, et al. Early time-restricted feeding improves insulin sensitivity. Cell Metab. 2018.
Chaix A, et al. Time-restricted feeding prevents metabolic diseases. Cell Metab. 2014.
Martens CR, et al. Caloric restriction and vascular aging. Cell Metab. 2016.
Canto C, Auwerx J. Targeting sirtuin 1 and sirtuin 3 for metabolic health. Trends Endocrinol Metab. 2012.
Gomes LC, Scorrano L. Mitochondrial morphology in disease. Nat Rev Mol Cell Biol. 2013.
Frank M, et al. Mitochondrial dynamics in health and disease. Cell. 2015.
Lopez-Otin C, et al. Metabolic control of longevity. Cell. 2016.
Corrisponding author: Gianluca Latino
Conflitti di interesse: nessuno dichiarato.
Finanziamenti: nessuno.
Disponibilità dei dati: non applicabile (articolo di revisione).
Approvazione etica: non richiesta.