Autore: Gianluca Latino
Data: 23 agosto 2025
Key Points
Le terapie incretiniche (agonisti GLP-1R e doppi agonisti GLP-1R/GIPR) e gli inibitori di SGLT2 costituiscono una piattaforma unificata di protezione cardiometabolica che trascende il controllo glicemico.
Le incretine agiscono su recettori GPCR di classe B1, modulando cAMP, flussi di Ca2+ e vie mediate da β-arrestina; i doppi agonisti amplificano gli effetti insulinotropi e anoressigeni in modo sinergico.
Le gliflozine ripristinano il feedback tubulo-glomerulare, riducono la pressione intraglomerulare e rimodellano l’assetto emodinamico-cardiorenale con benefici in HF e CKD, indipendenti dalla glicemia.
Trial di esito cardiovascolare e renale dimostrano riduzioni consistenti di MACE in selezionati GLP-1RA e robusti benefici su HF e progressione renale con SGLT2-i su ampio spettro di frazione di eiezione e funzione renale.
Frontiere emergenti: agonisti tripli GLP-1/GIP/GCGR, delivery orale dei peptidi, schemi a lunga durata e combinazioni razionali incretina + SGLT2-i in ottica di medicina di precisione.
Abstract strutturato
Background
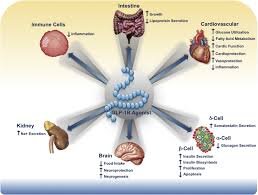
I disordini cardiometabolici presentano reti fisiopatologiche interconnesse che rendono insufficiente un approccio esclusivamente glucocentrico. Il sistema delle incretine e l’inibizione di SGLT2 agiscono su nodi di omeostasi energetica, fisiologia cardio-renale e regolazione neuroendocrina, ridefinendo la prevenzione del rischio multiorgano.
Obiettivi
Sintetizzare meccanismi molecolari, efficacia clinica e ampliamento delle indicazioni di agonisti del recettore del GLP-1 (GLP-1RA), doppi agonisti GLP-1R/GIPR e inibitori di SGLT2, delineando implicazioni pratiche e direttrici di ricerca.
Metodi
Revisione narrativa di trial pivotali cardiovascolari e renali, studi PK/PD e indagini meccanicistiche, integrata con raccomandazioni ADA/EASD e KDIGO più recenti e con evidenze su nuovi paradigmi terapeutici.
Risultati
GLP-1RA e tirzepatide migliorano controllo glicemico e peso tramite attivazione di GPCR di classe B1 con aumento di cAMP, modulazione del Ca2+ e segnali β-arrestina-dipendenti. Gli SGLT2-i forniscono protezione cardiorenale attraverso accoppiamento glucosio-natriuresi, ripristino del feedback tubulo-glomerulare e possibili effetti extra-renali tra cui inibizione di NHE3 cardiaco e rimodulazione metabolica.
Conclusioni
Le evidenze convergono verso una platform-therapy che ottimizza esiti multiorgano tramite meccanismi complementari. Gli agonisti tripli GLP-1/GIP/GCGR e i sistemi di somministrazione avanzati potrebbero espandere ulteriormente l’orizzonte della medicina cardiometabolica di precisione.
Parole chiave
Incretine; agonisti GLP-1; doppi agonisti GLP-1/GIP; inibitori SGLT2; malattia cardiometabolica; protezione multiorgano; medicina di precisione.
Introduzione
La transizione dalla glicemia al rischio cardiometabolico globale segna un cambio di paradigma nella medicina metabolica. Diabete tipo 2, obesità, malattia cardiovascolare aterosclerotica e malattia renale cronica condividono driver patogenetici che includono infiammazione cronica, disfunzione endoteliale, lipotossicità e iperfiltrazione glomerulare. Le incretine GLP-1 e GIP orchestrano la risposta post-prandiale modulando secrezione insulinica, soppressione del glucagone, svuotamento gastrico e segnali centrali dell’appetito. In parallelo, gli inibitori di SGLT2 agiscono sul riassorbimento tubulare prossimale del glucosio, innescando una cascata emodinamica-renale con ricadute sistemiche favorevoli. L’integrazione di queste classi consente una protezione multiorgano difficilmente raggiungibile con strategie tradizionali.
Box 1 | Algoritmo pratico “first-shot” per il T2D ad alto rischio
ASCVD documentata o rischio cardiovascolare elevato: iniziare con un agonista GLP-1R con beneficio MACE dimostrato; considerare aggiunta di SGLT2-i.
Scompenso cardiaco (HFrEF o HFpEF): SGLT2-i come terapia cardine, indipendentemente dal livello di HbA1c.
CKD (eGFR <60 ml/min/1,73 m² o albuminuria significativa): SGLT2-i di prima scelta; aggiungere GLP-1RA a lunga durata se serve ulteriore riduzione del rischio.
Obesità o target weight-centric: preferire incretino-terapie ad alta efficacia sul peso (GLP-1RA di nuova generazione o doppi agonisti GLP-1R/GIPR).
Necessità di evitare ipoglicemia: combinare incretina + SGLT2-i ± metformina prima di introdurre insulina prandiale.
Box 2 | Framework metodologico 2025–2035
Approccio traslazionale per integrare incretine e SGLT2-i
Disegno dei trial: CVOT (cardiovascular outcome trials) con endpoint duri, arruolamento stratificato per fenotipo (ASCVD, HF, CKD, obesità).
Endpoint primari: MACE (morte CV, infarto miocardico, ictus), ospedalizzazioni per HF, progressione della CKD.
Biomarcatori chiave: eGFR, albuminuria, NT-proBNP, hs-CRP, imaging cardiaco avanzato (strain ecocardiografico, risonanza magnetica), misure di composizione corporea.
Tecniche meccanicistiche: studi PK/PD, analisi recettoriale GPCR-biased, metabolomica su substrati energetici (glucosio, lipidi, chetoni).
Strategia combinata: trial factoriali (incretina + SGLT2-i), sequenziamento terapeutico razionale, analisi di real-world evidence (RWE).
Timeline 2025–2035:
2025–2027: consolidamento degli agonisti tripli GLP-1/GIP/GCGR.
2027–2030: validazione delle combinazioni fisse incretina + SGLT2-i.
2030–2035: diffusione di delivery orale peptidico di nuova generazione e sistemi long-acting trimestrali.
Meccanismi molecolari e proprietà farmacologiche
2.1 Biologia recettoriale incretinica e trasduzione del segnale
Il recettore GLP-1R appartiene ai GPCR di classe B1 con dominio N-terminale esteso. Il legame agonista promuove accoppiamento a Gs, attivazione dell’adenilato ciclasi e incremento di cAMP, con effettori PKA/EPAC, mobilizzazione di Ca2+ e reclutamento di β-arrestina che regola desensitizzazione e segnali alternativi.
Doppio agonismo GLP-1R/GIPR: tirzepatide mostra alta potenza funzionale su GIPR e attività sostanziale su GLP-1R. La co-attivazione produce incremento insulinotropo, maggiore calo ponderale e potenziale ottimizzazione della tollerabilità tramite differenziale traffico recettoriale.
2.2 Meccanismi degli SGLT2-i
Gestione renale del glucosio: SGLT2 nel segmento S1 riassorbe circa 90% del glucosio filtrato. L’inibizione competitiva induce glicosuria (circa 50–100 g/die) e natriuresi con ripristino del feedback tubulo-glomerulare, riduzione della pressione intraglomerulare e dell’iperfiltrazione.
Effetti extra-renali ipotizzati: modulazione di NHE3 cardiaco, miglioramento dell’efficienza energetica con uso di chetoni, riduzione dello stress ossidativo e potenziamento dell’autofagia; possibili contributi alla protezione in scompenso cardiaco e nefropatia.
Evidenze consolidate
3.1 Protezione cardiovascolare
SGLT2-i nello scompenso: dapagliflozin (DAPA-HF) ha ridotto del 26% l’endpoint composito in HFrEF; benefici confermati sull’intero spettro di frazione di eiezione da EMPEROR-Reduced/Preserved e DELIVER, con coerenza in pazienti con e senza diabete tipo 2. Meccanismi chiave: riduzione del precarico via natriuresi, miglioramento della pressione arteriosa, rimodellamento favorevole e ottimizzazione metabolica.
GLP-1RA e aterosclerosi: liraglutide (LEADER), semaglutide (SUSTAIN-6) e dulaglutide (REWIND) hanno dimostrato riduzioni significative dei MACE in popolazioni ad alto rischio, con segnali su funzione endoteliale, stabilizzazione di placca e attenuazione dell’infiammazione sistemica.
3.2 Protezione renale
CREDENCE e DAPA-CKD hanno documentato riduzioni marcate di esiti renali duri nei pazienti con diabete tipo 2 e CKD; EMPA-KIDNEY ha ampliato il beneficio anche a CKD non diabetica. La base fisiopatologica include de-stress glomerulare, minore lavoro tubulare, effetti anti-fibrotici e immunomodulazione.
3.3 Gestione del peso e metabolismo
Incretine: GLP-1RA e doppi agonisti riducono l’introito calorico mediante azione ipotalamica, rallentamento dello svuotamento gastrico e possibile termogenesi. Tirzepatide in fase 3 ha ottenuto riduzioni di peso del 15–20%, prossime a esiti bariatrici in selezionati sottogruppi.
SGLT2-i: perdita calorica diretta (circa 200–300 kcal/die), riduzione del grasso viscerale, aumento dell’ossidazione lipidica e maggiore flessibilità metabolica; contributo modesto ma sinergico con incretine.
Ipotesi speculative e direzioni emergenti
Agonisti tripli GLP-1/GIP/GCGR: potenziale sinergia su lipolisi epatica, termogenesi e riduzione della steatosi, con preservazione della massa magra.
Agonismo biased: progettazione di ligandi con preferenza G-protein rispetto a β-arrestina per massimizzare efficacia e tollerabilità.
Combinazioni intelligenti: sequenziamento o co-somministrazione incretina + SGLT2-i come architettura di base per fenotipi ad alto rischio cardiometabolico.
Implicazioni cliniche
Stratificazione fenotipica: ASCVD → GLP-1RA con esito cardiovascolare; HF → SGLT2-i; CKD → SGLT2-i ± GLP-1RA; obesità → incretine ad alta potenza.
Aderenza e scelta della formulazione: preferire preparazioni settimanali a lunga durata; opzione semaglutide orale nei soggetti che rifiutano iniezioni.
Integrazione nelle terapie esistenti: metformina resta base metabolica; evitare ipoglicemia con uso prudente di insuline e valutare combinazioni fisse GLP-1RA/insulina basale nei casi selezionati.
Tecnologie emergenti
Delivery orale dei peptidi incretinici mediante enhancer di permeabilità.
Formulazioni a lunghissima durata (mensili o trimestrali) per ridurre il carico terapeutico.
Combinazioni a dose fissa SGLT2-i con metformina o DPP-4-i per semplificare i regimi.
Sistemi smart con rilascio insulino-responsivo guidato dalla glicemia in sviluppo.
Etica, equità e policy
Allocazione prioritaria verso pazienti con ASCVD, scompenso cardiaco o CKD in cui il beneficio assoluto è maggiore.
Trasparenza su costi e accesso, con programmi di rimborso e supporto all’aderenza.
Uso responsabile off-label solo quando il razionale biologico è robusto e il profilo rischio-beneficio è favorevole.
Sostenibilità di sistema, includendo valutazioni costo-efficacia e impatti di lungo periodo.
Sicurezza e mitigazione del rischio
SGLT2-i: raro rischio di chetoacidosi euglicemica; educazione alle sick-day rules, sospensione temporanea in caso di stress acuto, monitoraggio dei chetoni nei profili a rischio. Incremento di infezioni micotiche genitali; counselling igienico e trattamento precoce.
Incretine: eventi gastrointestinali dose-dipendenti; titolazione graduale, ottimizzazione del timing, scelta di molecole con miglior tollerabilità; attenzione a predisposizioni a pancreatite e calcolosi biliare.
Farmacologia speciale: adattamenti in insufficienza renale o epatica, interazioni con diuretici o bloccanti del sistema renina-angiotensina, gestione peri-operatoria.
Limitazioni dell’evidenza e sfide implementative
Dati testa-a-testa limitati tra doppi o tripli agonisti e GLP-1RA consolidati.
Necessità di follow-up esteso per sicurezza di lungo periodo nelle nuove classi.
Sottorappresentazione di specifici gruppi etnici ed età estreme nei trial pivotali.
Costi e rimborsabilità eterogenei; barriere di accettabilità dei dispositivi iniettivi.
Conclusioni
Le incretine e gli inibitori di SGLT2 delineano una piattaforma cardiometabolica integrata, capace di ridurre eventi cardiovascolari, rallentare la progressione della malattia renale cronica e incidere sul peso corporeo con basso rischio di ipoglicemia. L’evoluzione verso agonisti multipli, sistemi di somministrazione avanzati e strategie combinate abilita scenari di medicina di precisione. L’adozione sistematica richiede selezione fenotipica, protocolli di sicurezza e politiche di accesso che massimizzino il valore clinico e sociale.
Bibliografia
- Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022 ADA/EASD Consensus Report. Diabetes Care. 2022;45(11):2753-2786.
- Kidney Disease: Improving Global Outcomes (KDIGO). KDIGO 2022 Clinical Practice Guideline for Diabetes Management in CKD. Kidney Int. 2022;102(4S):S1-S127.
- Zelniker TA, Braunwald E. Mechanisms of cardiorenal effects of SGLT2 inhibitors. J Am Coll Cardiol. 2020;75:422-434.
- McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in HFrEF (DAPA-HF). N Engl J Med. 2019;381:1995-2008.
- Packer M, Anker SD, Butler J, et al. Empagliflozin in HFrEF (EMPEROR-Reduced). N Engl J Med. 2020;383:1413-1424.
- Anker SD, Butler J, Filippatos G, et al. Empagliflozin in HFpEF (EMPEROR-Preserved). N Engl J Med. 2021;385:1451-1461.
- Solomon SD, McMurray JJV, Claggett B, et al. Dapagliflozin in HFpEF (DELIVER). N Engl J Med. 2022;387:1089-1098.
- Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and renal outcomes (CREDENCE). N Engl J Med. 2019;380:2295-2306.
- Heerspink HJL, Stefansson BV, Correa-Rotter R, et al. Dapagliflozin in CKD (DAPA-CKD). N Engl J Med. 2020;383:1436-1446.
- EMPA-KIDNEY Collaborative Group. Empagliflozin in CKD. N Engl J Med. 2023;388:117-127.
- Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes (LEADER). N Engl J Med. 2016;375:311-322.
- Marso SP, Bain SC, Consoli A, et al. Semaglutide and cardiovascular outcomes (SUSTAIN-6). N Engl J Med. 2016;375:1834-1844.
- Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and cardiovascular outcomes (REWIND). Lancet. 2019;394:121-130.
- Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes (DECLARE-TIMI 58). N Engl J Med. 2019;380:347-357.
- Bhatt DL, Szarek M, Pitt B, et al. Sotagliflozin in diabetes and CKD (SCORED). N Engl J Med. 2021;384:129-139.
- Bhatt DL, et al. Sotagliflozin in recent worsening heart failure (SOLOIST-WHF). N Engl J Med. 2021;384:1419-1430.
- Jastreboff AM, Aronne LJ, Ahmad NN, et al. Tirzepatide once weekly for obesity (SURMOUNT-1). N Engl J Med. 2022;387:205-216.
- Frías JP, Davies MJ, Rosenstock J, et al. Tirzepatide vs semaglutide (SURPASS-2). N Engl J Med. 2021;385:503-515.
- Wilding JPH, Batterham RL, Calanna S, et al. Semaglutide 2.4 mg in obesity (STEP 1). N Engl J Med. 2021;384:989-1002.
- SELECT Trial Investigators. Semaglutide and major cardiovascular events in patients with CVD and overweight or obesity (SELECT). N Engl J Med. 2023;389:2221-2232.
- Zhao P, Liang Y-L, Belousoff MJ, et al. Activation of GLP-1R by a non-peptidic agonist. Nature. 2020;577:432-436.
- Jones B, Buenaventura T, Kanda N, et al. Distinct β-arrestin complexes at GLP-1 and glucagon receptors. Nat Commun. 2018;9:1506.
- Coskun T, Sloop KW, Loghin C, et al. Dual GIP/GLP-1 co-agonist LY3298176. Mol Metab. 2018;18:3-14.
- Nauck MA, Quast DR, Wefers J, Meier JJ. GLP-1 receptor agonists in type 2 diabetes: state of the art. Mol Metab. 2021;46:101102.
- Andersen A, Lund A, Knop FK, Vilsbøll T. GLP-1 in health and disease. Nat Rev Endocrinol. 2018;14:390-403.
- Standl E, Schnell O, McGuire DK. Heart failure considerations of glucose-lowering drugs. Circ Res. 2016;118:1830-1843.
- Griffin M, Rao VS, Ivey-Miranda J, et al. Mechanisms of SGLT2 inhibitors in heart failure. Circulation. 2020;142:1723-1735.
- Filippatos G, Anker SD, Pitt B, et al. SGLT2 inhibitors across the ejection fraction spectrum: meta-analytic insights. Eur Heart J. 2022;43.
- Vallon V, Thomson SC. Targeting renal transporters in diabetes. Physiol Rev. 2020;100:2117-2204.
- KDIGO. CKD guideline synopsis. Ann Intern Med. 2023;176.
Corrisponding author: Gianluca Latino
Conflitti di interesse: nessuno dichiarato.
Finanziamenti: nessuno.
Disponibilità dei dati: non applicabile (articolo di revisione).
Approvazione etica: non richiesta.